Bộ Y tế thu hồi giấy đăng ký lưu hành ba loại thuốc
Ngày 4/6, Cục Quản lý Dược (Bộ Y tế) đã ban hành quyết định thu hồi ba loại thuốc theo đề nghị tự nguyện từ các đơn vị đăng ký. Cụ thể, ba sản phẩm bị thu hồi số đăng ký gồm:
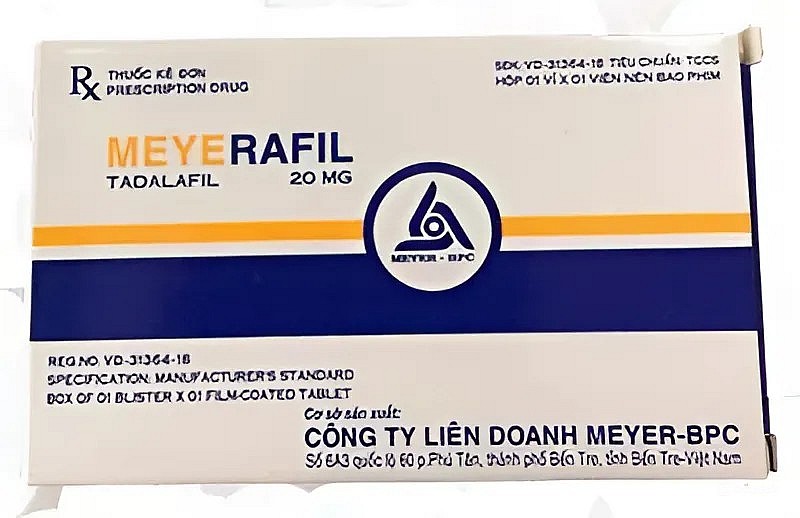 |
| Tadalafil 20 mg. |
Tadalafil 20 mg (số đăng ký 893110457024), do Công ty Liên doanh Meyer-BPC (Bến Tre) đăng ký và sản xuất, dùng trong điều trị rối loạn cương dương.
Odistad 120 (Orlistat 120 mg, số đăng ký 893100515124), thuốc điều trị béo phì do Công ty TNHH Liên doanh Stellapharm (TP.HCM) sản xuất tại Chi nhánh 1 ở Bình Dương.
Vacobufen 400 (Ibuprofen 400 mg, số đăng ký 893100032324), thuốc giảm đau, hạ sốt do Công ty Cổ phần Dược Vacopharm (Long An) đăng ký và sản xuất.
Đáng chú ý, trong đơn gửi Cục Quản lý Dược, Công ty Stellapharm cho biết lý do xin rút số đăng ký Odistad 120 là "không còn nhu cầu kinh doanh sản phẩm này". Theo hồ sơ, số đăng ký này sẽ hết hiệu lực vào ngày 31/12/2025.
Đại diện Stellapharm lý giải rằng Chi nhánh 1 của công ty hiện có hai số đăng ký lưu hành đối với thuốc Orlistat 120 mg. Trong đó, số đăng ký 893100096524 được cấp ngày 31/1/2024 vẫn đang được lưu hành. "Công ty đang lưu hành sản phẩm với số đăng ký 893100096524 nên xin thu hồi số đăng ký còn lại theo quy định", vị này nêu rõ.
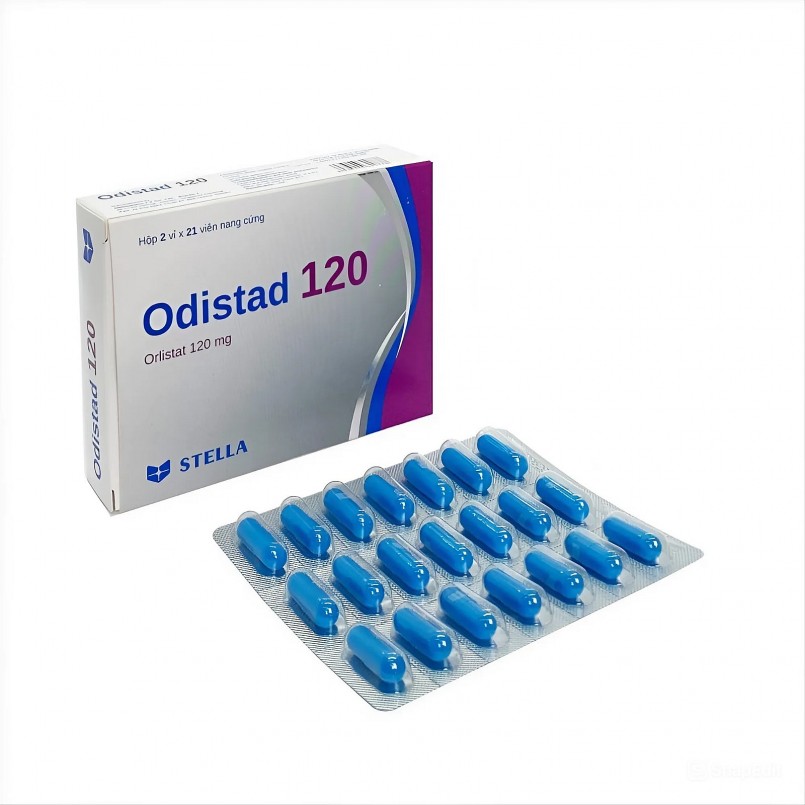 |
| Orlistat 120 mg. |
Theo khoản 1, Điều 46 của Thông tư 08/2022/TT-BYT, một cơ sở sản xuất không được duy trì cùng lúc nhiều hơn hai thuốc có cùng thành phần, dạng bào chế, hàm lượng... trong một đơn vị phân liều. Việc thu hồi nhằm tuân thủ quy định về đặt tên và kiểm soát số lượng đăng ký lưu hành.
Cục Quản lý Dược khẳng định: Các thuốc được sản xuất trước ngày 3/6/2025 vẫn được phép lưu hành đến hết hạn sử dụng. Tuy nhiên, các đơn vị đăng ký và sản xuất phải chịu trách nhiệm đầy đủ về chất lượng, an toàn và hiệu quả của thuốc trong quá trình lưu hành.
Theo ông Tạ Mạnh Hùng – Phó Cục trưởng Cục Quản lý Dược, việc doanh nghiệp tự nguyện xin rút số đăng ký là điều bình thường khi họ không còn nhu cầu sản xuất hoặc kinh doanh. Tuy nhiên, “thời gian gần đây có nhiều doanh nghiệp tự nguyện xin rút số hơn”, ông Hùng cho biết.
Động thái này diễn ra trong bối cảnh ngành y tế đang siết chặt kiểm tra, giám sát lĩnh vực dược phẩm. Bộ Y tế đã thành lập 15 tổ kiểm tra đột xuất đối với dược phẩm, mỹ phẩm, thực phẩm chức năng, thiết bị y tế... trong tháng cao điểm phòng chống hàng giả, gian lận thương mại kéo dài đến ngày 15/6.
Trước đó, nhiều vi phạm đã được phát hiện liên quan đến chất lượng, hồ sơ đăng ký, và việc tuân thủ quy chuẩn sản xuất. Theo báo Tuổi Trẻ, Bộ Y tế yêu cầu các doanh nghiệp thực hiện nghiêm tiêu chuẩn GMP (thực hành tốt sản xuất thuốc), đồng thời kiểm soát chặt chẽ nguồn gốc nguyên liệu – yếu tố quyết định chất lượng thuốc.
Bộ Y tế cũng nhấn mạnh: Thuốc là hàng hóa đặc biệt, ảnh hưởng trực tiếp đến sức khỏe con người, do đó mọi khâu từ sản xuất, đăng ký đến lưu hành đều phải tuân thủ nghiêm ngặt quy định pháp luật. Một khi bị thu hồi số đăng ký, thuốc không còn được phép lưu hành trên thị trường.
 Ăn gì ngày Tết Đoan Ngọ để diệt sâu bọ? Ăn gì ngày Tết Đoan Ngọ để diệt sâu bọ? |
 Nguyên nhân Bộ Y tế thu hồi 294 số tiếp nhận phiếu công bố mỹ phẩm? Nguyên nhân Bộ Y tế thu hồi 294 số tiếp nhận phiếu công bố mỹ phẩm? |
 TP.HCM ghi nhận hai ca tử vong do Covid-19, số ca mắc đang tăng nhanh TP.HCM ghi nhận hai ca tử vong do Covid-19, số ca mắc đang tăng nhanh |
Cùng chuyên mục
Tin khác

Hào quang ảo và hệ sinh thái “trăm tỷ” của “Huấn Hoa Hồng”

Bộ Y tế đề xuất tăng gấp đôi mức phạt vi phạm an toàn thực phẩm

Thu hồi toàn quốc 3 sản phẩm mỹ phẩm “nhãn hàng Vinamake” vì vi phạm chất lượng

Khiếu nại hoàn tiền tăng mạnh trong mua sắm thương mại điện tử

An toàn thực phẩm lại nóng: 9 loại sữa dinh dưỡng Dược Homel bị thu hồi hồ sơ công bố

Điểm tên loạt mỹ phẩm sai phạm của Quốc tế Đại Cát Á

Điểm tên sản phẩm trong đường dây sản xuất dầu ăn giả quy mô lớn tại Hưng Yên

Hà Nội tăng cường kiểm soát cơ sở sản xuất nông, lâm, thủy sản để bảo đảm an toàn thực phẩm

Hà Nội triệt phá đường dây “hô biến” thịt trâu thành thịt bò Wagyu



















